键角的比较
比较键角大小的几种常见类型
1、SeO42-、SeO3
两种微粒中心原子杂化方式不同,SeO42-中Se采用sp3杂化,而SeO3中Se采用sp2杂化,故键角SeO3>SeO42-
类似的可以这样处理的有:SO42-与SO3等
2、CH4、NH3、H2O
三种分子的VSEPR模型都是四面体,但氨分子中一对孤电子对,水分子中有2对孤电子对。因为孤电子对之间的斥力>孤电子对与σ键电子对之间的斥力>σ键电子对之间的斥力,故键角CH4>NH3>H2O
类似的可以这样处理的有:H3O+与H2O ;NH4+与NH3 ;CH3+与CH4 ;氮化硅Si3N4中∠N-Si-N与∠Si-N-Si ;SO2与SO3等
3、H2O、H2S
两种分子的VSEPR模型都是四面体,中心原子价层电子对数相同,孤电子对数相同,中心原子的成键原子相同。不同点:中心原子电负性O>S。中心原子电负性越大,成键原子离中心原子的距离越近,成键电子对之间的斥力越大,故键角H2O>H2S。
类似的可以这样处理的有:NH3、PH3与AsH3等
4、NH3、NF3
两种分子的VSEPR模型都是四面体,中心原子相同,中心原子的价层电子对数相同,孤电子对数相同。不同点:中心原子的成键原子不同,电负性:F>H。成键原子电负性越大,键角越小。原因:成键原子电负性越大,成键电子对偏向电负性大的原子(相对),成键电子对之间的斥力较小,故键角较小。
5、立体构型问题
① SF4
因为键角为90°时的排斥力>120°>180°时的排斥力。因此,在VSEPR模型中,以含90°的l-l电子对排斥作用和l-b电子对排斥作用较少的构型为分子较稳定的构型。SF4分子构型为跷跷板型(一对孤对电子对位于三角形平面上),而非三角锥体。
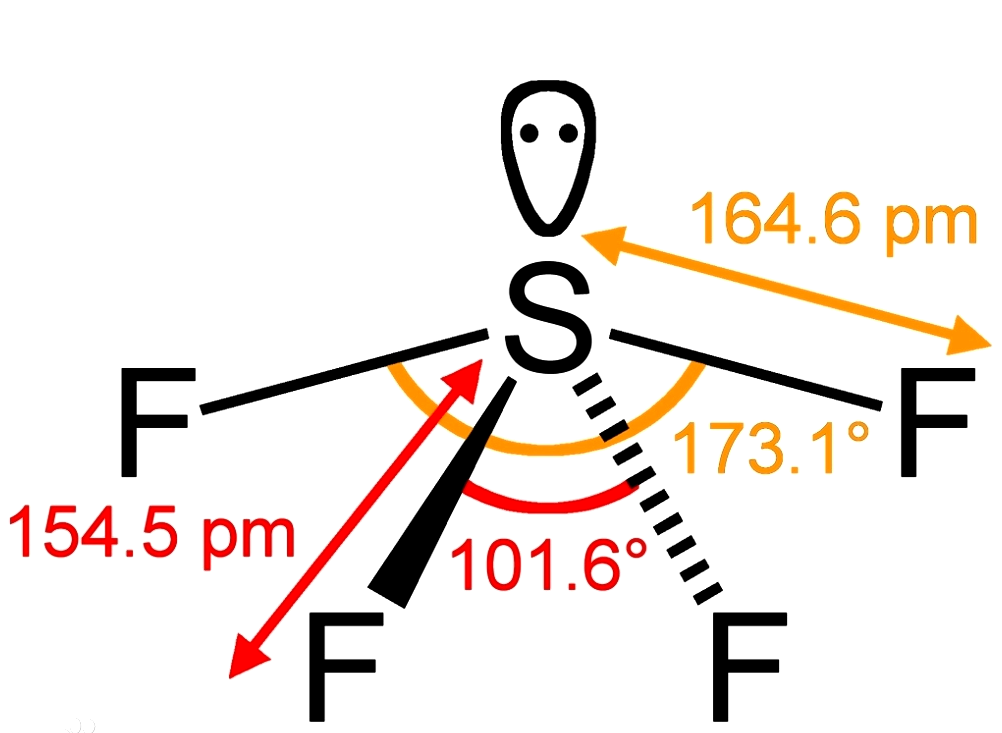
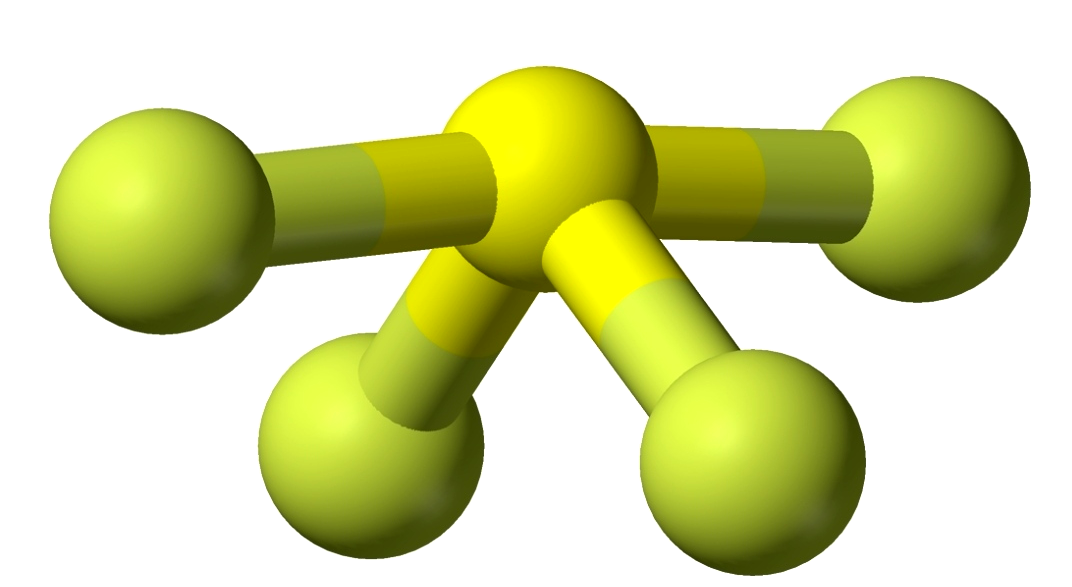
由于孤电子对有较大的排斥作用,挤压三角平面的键角使之小于120度,同时挤压三角平面的键角使之小于120度,同时挤压轴线方向的键角内弯,使之大于180度。如上图图示,SF4分子的构型为变形四面体。
② OSF4
因为价层电子对之间斥力的大小顺序为t-t>t-d>d-d>d-s>s-s,则在此分子中,以含90°的d-s的排斥作用较少的构型为分子较稳定的构型。即,S=O在赤道面上(平面三角形)。
③ ICl2-
中心原子I有三对孤电子对,则分子以含90°的l-l排斥作用较少的构型为分子较稳定的构型,则三对孤电子对都位于平面三角形上(赤道面上)。离子构型为直线形。
